Parmi les milliers de minéraux recensés, une vingtaine à peine constituent près de 80% de la masse totale des minéraux de l’écorce terrestre. Parmi ceux-là, le quartz déjà cité, le feldspath (silicate d'aluminium, potassium, sodium ou calcium) et la calcite (carbonate de calcium).
Leur histoire : Avant d’être « minéraux », ils ont été très souvent des particules en suspension dans l’eau qui se sont agglomérés (les roches sédimentaires en étant un cas particulier) ; ainsi, par exemple, la chute régulière pendant des milliers d’années d’une goutte d’eau chargée en calcite peut donner naissance à des stalagmites en calcite cristallisée. Mais ce sont également dans les profondeurs de la terre que se forment les cristaux … à hautes températures et sous de fortes pressions . A cet égard, sont également à noter les sédiments ayant été confrontés « tardivement » à ces conditions extrêmes. Enfin, ce sont parfois le passage instantané à l’état solide de gaz volcaniques (phénomène de sublimation) qui donne naissance à certains minéraux (une des origines du soufre).
Goupe Période |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
| 1 | H1 ••• |
Electronégativité
croissante |
(pouvoir d’attraction d’électrons) | He2 |
||||||||||||||
| 2 | Li3 •• |
Be4 •• |
Présence
à l’état naturel (minerais) : faible (•) – moyenne (••) - fréquente (•••) |
|
B5 •• |
C6 •• |
N7 |
O8 ••• |
F9 •• |
Ne105 |
||||||||
| 3 | Na11 ••• |
Mg12 ••• |
|
Al13 ••• |
Si14 ••• |
P15 •• |
S16 •• |
Cl17 •• |
Ar18 |
|||||||||
| 4 | K19 ••• |
Ca20 ••• |
Sc21 • |
Ti22 •• |
V23 • |
Cr24 • |
Mn25 •• |
Fe26 ••• |
Co27 • |
Ni28 • |
Cu29 • |
Zn30 • |
Ga31 |
Ge32 |
As33 • |
Se34 |
Br35 |
Kr36 |
| 5 | Rb37 • |
Sr38 •• |
Y39 • |
Zr40 •• |
Nb41 • |
Mo42 •• |
Tc43 |
Ru44 |
Rh45 |
Pd46 |
Ag47 • |
Cd48 • |
In49 |
Sn50 •• |
Sb51 •• |
Te52 |
I53 |
Xe54 |
| 6 |
Cs55 • |
Ba56 •• |
»» |
Hf72 •• |
Ta73 •• |
W74 •• |
Re75 |
Os76 |
Ir77 |
Pt78 • |
Au79 • |
Hg80 • |
Tl81 • |
Pb82 •• |
Bi83 • |
Po84 |
At86 |
Rn35 |
| 7 | Fr87 |
Ra88 |
»» |
Rf104 |
Db105 |
Sg106 |
Bh107 |
Hs108 |
Mt109 |
Ds110 |
Rg111 |
Cn112 |
Uut113 |
Uuq114 |
Uup115 |
Uuh116 |
Uus117 |
Uuo118 |
| 8 | »» | La57 • |
Ce58 • |
Pr59 • |
Nd60 • |
Pm61 |
Sm62 • |
Eu63 • |
Gd64 • |
Tb65 • |
Dy66 • |
Ho67 • |
Er68 • |
Tm69 • |
Yb70 • |
Lu71 • |
||
| 9 | »» | Ac89 |
Th90 • |
Pa91 |
U92 • |
Np93 |
Pu94 |
Am95 |
Cm96 |
Bk97 |
Cf98 |
Es90 |
Fm100 |
Md101 |
No102 |
Lr103 |
||
| NON métaux | M | 6 |
alcalins | Très réactifs, jamais à l'état élémentaire dans la nature. Réaction immédiate à l’humidité. | |
| 7 |
Non métaux | E | 6 |
alcalino-Terreux |
« métaux de terre », résistant au feu. Leurs oxydes restent solides à haute température. |
| 6 |
Halogènes | T | 15 |
Lanthanides | Appelés encore « terres rares ». Etymologie du grec (rester caché). |
| 7 |
Gaz rares | A | 15 |
Actinides | Métaux lourds, radioactifs. L’Uranium (isolé en 1789 !) et le Thorium sont abondants à l'état naturel. |
| Métalloïdes : entre ... | U | 38 |
de transition | Forte conductivité. Densité et d° de fusion élevées. générent des ions et plusieurs états d’oxydation. | |
| 7 |
... métal et non-métal |
X | 11 |
Pauvres | Mous (sauf Al). Par rapport aux métaux de transition, plus grande électronég., moindre d° de fusion. |
Argile : Constituée de très fines particules issues de la désagrégation de roches (généralement des silicate). C’est donc un matériau sédimentaire dont une particularité est la consistance variable en fonction de sa teneur en eau (on parle de sa « plasticité »).
Basalte (le) : Roche magmatique éruptive, c.-à-d. qui s’est refroidi rapidement au contact de l’air ou/et de l’eau au sortir d’un volcan. Il est le principal constituant de la croûte terrestre « océanique ». Sa structure est dite « microlithique, c.-à-d. constituées de petits bâtonnets (taille de l’ordre du millimètre) enveloppés d’une pâte vitreuse. Sa composition : ~ 50% de silice (SiO2), ~15% d’alumine (Al2O3) et autant d’oxyde de magnésium (MgO).
Calcaire : Roche sédimentaire, composée principalement de carbonate de calcium (CaCO3) et secondairement de carbonate de magnésium (MgCO3).
Calcite : Minéral composé de carbonate naturel de calcium (CaCO3) et de traces de métaux. Sa cristallisation dans le système rhomboédrique est très caractéristique. A l’état pur, la calcite est transparente et présente des propriétés optiques originales (biréfringence du « spath
d’Islande »).
Corps simples : Substance pure, dont le plus petit constituant est « l’atome », lui-même constitué d’un noyau autour duquel gravitent des électrons. Ils sont au nombre d’une centaine qu’on a l’habitude de classer dans un tableau (dit « tableau périodique de Mendeleïev »). Seuls environ 60 d’entre eux se rencontrent plus ou moins fréquemment à l’état naturel (et seulement une dizaine très fréquemment). Ils se rangent selon 2 grandes catégories (les Métaux et les Non-métaux) et une catégorie intermédiaire (les métalloïdes, à mi-chemin des caractéristiques des 2 premières). [voir Tableau de Mendeleïev]
Noms, Symboles et pourcentage dans l'écorce terrestre des corps simples les plus fréquents
| Noms | % | Observations |
| Oxygène (O) |
60 | (par perte de ses 2 électrons) l'ion O-2 génère des « oxydes » avec beaucoup de corps simples dont des métaux (oxydes de …) |
| Silicium (Si) |
20 à 25 | Apparaît toujours associé à l’oxygène : SiO2, dioxyde de silicium, alias Silice (sable, quartz …) et sous forme de silicates (SiO4 … composant de toutes les variétés de feldspaths). |
| Aluminium (Al) |
6 | Métal le + abondant. Lié à d’autres éléments / le cation Al +3 … exemple : Bauxite (contenant de l’alumine Al2O3 et des oxydes de fer) |
| Hydrogène (H) |
3 | Sous forme d’eau (H2O) et de composés comprenant le radical (hydroxyde) OH- qui apparaît dans les « bases » (chaux vive, soude…) |
| Sodium (Na) |
2,5 | Métal alcalin fréquent sur terre (dans les Feldspaths dits sodiques) et surtout … dans les mers (via le sel ClNa) |
| Calcium (Ca) |
2 | Présent à travers des sels minéraux. Exemples : Carbonates comme la calcite (CaCO3), sulfates comme le gypse (CaSO4 + 2H2O) … |
| Fer (Fe) | 2 | Métal de transition très fréquent, associé à beaucoup de corps composés. |
| Magnésium (Mg) |
<2 | Métal dans les silicates ferromagnésiens et les « dolomies », roches sédimentaires, carbonate double de Ca et de Mg (CaMg(CO3)2 |
| Potassium (K) |
>1 | Métal alcalin : dans les feldspaths (silicate double de métaux dont K, 1 des roches les + fréquente) et dans le mica (silicate de K et Al) |
| Titane (Ti) | <0,3 | Métal de transition qui n’est présent qu’à l’état d’oxydes |
Craie : Roche bio-détritique (sédiments de squelettes d’organismes marins), donc presque entièrement constituée de carbonate de calcium (CaCO3). Elle a parfois une forte teneur en argile ou peut être encore dolomitique [à base de bicarbonate de calcium et de magnésium / CaMg(CO3)2].
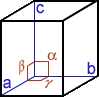
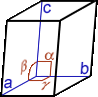
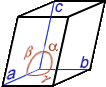
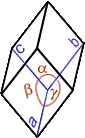
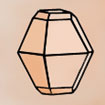
Cristal, cristallin(e) (structure …) : A part un petit nombre de minéraux dits « amorphes » (sans forme), la plupart d’entre eux ont une structure particulière, propre à chaque minéral et identique en interne comme en externe ; en clair, le plus petit élément composant le minéral a la même forme que le minéral tout entier. La structure cristalline d’un minéral donné se définit par une forme particulière, c.-à-d. propre à ce minéral, limitée par des surfaces planes respectant toujours entre elles des angles précis. On dénombre 7 familles de systèmes cristallins caractérisés notamment par leur(s) centre, axe(s) et plan(s) de symétrie(s) [dans le tableau synthétique suivant, on donne pour chaque système cristallin : le NOM, la Forme de la maille élémentaire, les Symétries, les valeurs comparées des longueurs a, b, c et des angles α, β, γ et quelques exemples de cristaux dans chaque famille]
| CUBIQUE (= isométrique) cube a=b=c / α=β=γ= 90° |
QUADRATIQUE (= tétragonal) prisme droit à 4 faces rect. id. + 2 bases carrées id. a=b≠c / α=β=γ= 90° |
ORTHOROMBIQUE prisme droit
à 4 faces rectangles identiques 2 à 2 + 2 bases rectang.
a≠b≠c / α=β=γ= 90° |
MONOCLINIQUE prisme oblique 2 faces parallélog. id. + 2 bases rectangles a≠b≠c / α=γ= 90° β≠ |
TRICLINIQUE prisme oblique 4 faces latérales + bases parallélog. id. 2 à 2 a≠b≠c / α≠β≠γ≠ 90° |
RHOMBOÉDRIQUE (= trigonal) 6 faces losanges identiques a=b=c / α=β=γ≠ 90° |
HEXAGONAL prisme droit 6 faces rectang. id. + 2 bases hexag. a=b≠c / α=β=90° γ=120° |
Si le cristal tournant autour d'un
axe se recouvre lui-même « n » fois, on dit qu'il
dispose d'un axe de symétrie d'ordre « n ». |
||||||
 |
 |
 |
 |
 |
 |
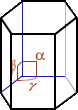 |
1 Centre 1 Axe d’ordre 4 6 plans Miroirs |
1 Centre 1 Axe d’ordre 4 2 Axes d'ordre 2 5 plans Miroirs |
1 Centre 3 Axe d'ordre 2 3 plans Miroirs |
1 Axe d'ordre 2 1 plan Miroir |
1 Centre |
1 centre 1 Axe d'ordre 3 3 Axes d'ordre 2 3 plans Miroirs |
1 Axe d'ordre 6 3 Axes d'ordre 2 7 plans Miroirs |
Sel gemme-galène |
Zircon |
Barytine |
Gypse |
Feldspath sodique |
Calcite |
Béryl |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
Magnétite-Pyrite |
Apophyllite |
Soufre |
Feldspath alcalin |
Rhodonite |
Quartz |
Graphite |
Diagenèse : Ensemble des processus physiques et chimiques avec ou non le concours d’êtres vivants (bactéries par exemple) qui permettent de transformer des sédiments en roches sédimentaires bien compactes. Exemple : le grès issu de l’agrégation de grains de sable.
Ductilité : capacité à se déformer sans rompre d'un matériau
Ecorce terrestre (croûte …) : Sa profondeur est d’environ 35 km sous un relief plat. A sa surface, on trouve sur 75% des territoires des roches sédimentaires, qui ne représentent pourtant que 5% du volume total des roches.
Electronégativité : grandeur mesurant pour un corps simple (ou combinaison de corps simples) son pouvoir d’attraction d’électrons à la base de la formation de liaisons chimiques. Là encore, le tableau périodique de Mendeleïev se révèle d’une grande utilité : sur une ligne horizontale du tableau (dite « période »), l’électronégativité des corps augmente de gauche à droite. De même, l’électronégativité des corps alignés verticalement (appartenant généralement à une même famille dite « groupe») augmente de bas en haut. Ainsi le Fluor (symbole F à droite et en haut du tableau) présente une forte électronégativité, tandis que le Francium (symbole Fr à l’opposé du tableau, en bas et à gauche) est celui des corps simples ayant l’électronégativité la plus faible. La combinaison entre 2 éléments sera d’autant plus facilitée que leur différence d’électronégativité sera plus grande.
Feldspaths : Groupe de minéraux le plus important au plan volumétrique de l’écorce terrestre. Ce sont tous des silicates d'aluminium, potassium, sodium ou calcium) qui cristallisent dans les modes monoclinique et triclinique.
Granit : Roche magmatique plutoniques, c.-à-d. qui s’est refroidi lentement dans les profondeurs de l’écorce terrestre. Elle est le principal constituant de la partie inférieure de la croûte terrestre « continentale ». On y perçoit des grains visibles à l’œil nu (on parle de structure « grenue ») de mica noir (biotite) et/ou blanc (muscovite), de quartz et de feldspath. Sa composition : principalement des silicates (SiO2…) de sodium (Na), potassium (K) et dans une moindre mesure d’aluminates (Al2O3).
Grès : Roche sédimentaire obtenue par agrégation de grains de sables dont le « ciment » est généralement issus de la déshydratation de solutions de sels. D’où l’extrême variété des grès en fonction des types de sels : calcaires (s’il s’agissait de carbonates), siliceux (si c’étaient des silicates), …
Ion : Elément
chimique chargé électriquement. Ainsi, un métal,
par la perte d’un ou plusieurs électrons devient un ion positif,
dit
« cation » (puisqu’en électrolyse attiré
par la cathode). Exemples : (sodium) Na+, (potassium) K+,
(magnésium) Mg2+… Symétriquement, un corps
simple ou composé peut se charger négativement en captant
un ou plusieurs électrons et ainsi devenir un « anion »
(puisqu’en électrolyse attiré par l’anode).
Exemples : chlorure (Cl -), sulfure (S-2), sulfate
(SO4-2), nitrate (NO3-) …
Magmatique
: Qualifie les roches issues du refroidissement plus ou moins rapide du
magma (roches en fusion sous la couche terrestre). Cette transformation
peut se faire en profondeur (roches « plutoniques » alias
« intrusives ») ou en surface (roches « éruptives
» alias
« effusives »). Parmi les premières,
les granits sont les plus fréquentes ; parmi les secondes, les
basaltes sont largement majoritaires.
Mais, pour l’une et pour l’autre des familles de roches magmatiques,
la cristallisation se fait en général en profondeur.
Malléabilité : assez proche de ductibilité,
propriété première d’un matériau, et
notamment un métal, en en permettant le laminage et le forgeage.
Marbre : Roche issue de la transformation métamorphique
(c.-à-d. ayant subit de fortes pressions et/ou de très hautes
températures) de calcaires, sédiments
à base principalement de carbonate de calcium (CaCO3).
Marne : Roche sédimentaire
comportant à proportions à peu près égales du calcaire (carbonates de
calcium CaCO3) et de l'argile (silicates).
Métal, métaux : Ils constituent plus de 90% des corps
simples et se décomposent eux-mêmes en 6 sous-catégories
: métaux … Alcalins, alcalino-terreux, lanthanides, actinides,
de transition, post-transition.
Leurs propriétés communes sont principalement les suivantes
:
- solides dans les conditions normales de température et de pression
avec une exception pour le mercure ;
- perdent facilement des électrons périphériques
pour générer des cations (« ions » chargés
positivement et donc attirés en électrolyse par la cathode)
;
- présents dans la nature sous forme de minéraux le plus
souvent « cristallisés » …
- purs (métaux natifs / or, argent, cuivre, platine) ou associés
à d’autres métaux (alliages plutôt rares à
l’état naturel) … ou …
- associés à des « non-métaux » (le plus
souvent dans des « oxydes ») ;
- bons conducteurs électriques et thermiques ;
- propriété ferromagnétique pour certains métaux
(fer, cobalt, nickel).
Minerai : roche contenant des minéraux utiles, en quantité
suffisante pour en justifier l'extraction industrielle.
Minéral : substance généralement non-organique,
naturelle ou artificielle (synthèse) caractérisée
par sa composition chimique (association de corps simples) et l'agencement
de ses atomes qui révèle généralement un système
cristallin. Les minéraux sont le plus souvent solides
à l’état naturel (si les conditions de température
et de pression sont normales). C’est l’association de minéraux
qui forme les roches du corps terrestre.
Métamorphisme, métamorphique :
Regroupe (ou qualifie) l'ensemble des transformations que peuvent subir
les roches confrontées à des changements de températures
et de pression extrêmess. Ainsi par exemple, des sédiments
calcaires peuvent se transformer en marbres, d’autres
sédiments argileux en schistes
… Mais, de telles transformations peuvent aussi toucher des roches
déjà antérieurement forgées par des pressions
et températures extrêmes en en modifiant par exemple la structure
cristalline.
Non-métal, non-métaux
: Ils sont très fréquemment rencontrés dans
la nature (et tout particulièrement : Hydrogène, Carbonne,
Oxygène, Phosphore et Soufre) et sont présents dans la plupart
des molécules vivantes. Par comparaison aux métaux, leurs
principales propriétés communes sont les suivantes :
- densité, températures de changement d'état, conductivité
(électrique et thermique) inférieures à celles des
métaux ;
- forte électronégativité (capacité d’attraction
d’électrons) ;
- oxydes acides ;
- peu malléable à l'état solide.
Oxyde : Composé d’un
élément chimique avec de l’oxygène. La plupart
des minéraux à l’état naturel sont des oxydes.
Exemple : la rouille est un oxyde de fer, le corindon (Al2O3)
un oxyde d'aluminium …
Autres exemples d’oxydes de métaux :
- Bauxite : roche ayant une forte teneur en alumine (oxyde d’aluminium
/ Al2O3) et dans une moindre mesure de l’oxydes
de fer (Fe2O3).
- Hématite : minéral composé principalement d’oxyde
de fer (Fe2O3) ajouté à des traces
de différents métaux (titane, aluminium, manganèse).
- Ilménite : minéral combinant dans un oxyde … du
fer et du titane (FeTiO3) ainsi que des traces de manganèse.
- Rutile : dioxyde de titane (TiO2) comportant des traces de
fer (jusqu’à 10 %) et d’autres métaux.
Polymorphisme : Voir
Allotropie
Porphyres : Vaste famille de roches magmatiques
présentant de grands cristaux de feldspath prisonniers d’une
pâte dont on ne perçoit pas le grain. Deux couleurs prépondérantes
: rouge et vert.
Sable : Issu de la désagrégation d’une multitude de roches et tout particulièrement du granit, raison pour laquelle il comprend souvent des grains de quartz, de feldspath et de mica. Il peut prendre différentes couleurs : noir quand il intègre des débris de roches volcaniques, blanc quand il comprend par exemple de fines particules de gypse ou des débris de coquillage (calcaire).
Schiste : Roches sédimentaire argileuse d’aspect feuilleté susceptible d’avoir subit une transformation métamorphique (c.-à-d. ayant été confrontée à de fortes pressions et/ou de très hautes températures). Dans ce dernier cas, le schiste est beaucoup plus résistant comme l’ardoise, la lauze, le micaschiste ou le gneiss.
Sédiment, sédimentaire : Roches composées de débris (qualifiées de « détritiques » par référence à détritus) issus de l’érosion d’autres roches (on parle alors de sédiments « terrigènes ») ou de squelettes d’êtres vivants (on parle alors de sédiments « bio-détritiques »). Par définition, elles s’accumulent à la surface de l’écorce terrestre dont elles occupent 75% de la superficie, mais elles ne représentent que 5% du volume de l’écorce toute entière. Parmi les roches sédimentaires les plus courantes, citons : (terrigènes) sable, grès, argile … et (bio-détritiques) charbon, calcaire …
Les sédiments se formant souvent dans les grandes profondeurs des océans et étant parfois touchés par les mouvements tectoniques (dérive des continents à l’origine de la formation des montagnes), ils peuvent avoir été soumis à de très fortes pressions et des hautes températures. De ces phénomènes, résulte la naissance de nouveaux types de roches sédimentaires dites « métamorphiques ». Citons en quelques unes : marbre (à base de calcaire) et schistes (ardoise, micaschiste, gneiss …).
Sel : Donnons quelques exemples de « sels » courants parmi les minéraux : carbonate de calcium (composant principale des roches calcaires, CaCO3,), sulfate de calcium (hydraté, dit gypse, CaSO4 2H2O), chlorure de sodium (sel marin, Cl Na), silicate (comprenant le radical SiO2 – Le feldspath, un des composants majeur de la croûte terrestre, est un silicate double d’un ou plusieurs des métaux aluminium/ potassium/ sodium/ calcium). En fait, un sel naît de la réunion d’un ion négatif (anion) et d’un ion positif (cation) (comme Cl - et Na+ pour le sel marin) qui, de ce fait, est électriquement neutre.
Silicate : Minéraux (neutre comme tous sels) dont la structure est un composé de silice et d’oxygène (SiO4) et de métaux : aluminium (Al), calcium (Ca), fer (Fe), potassium (K), magnésium (Mg) et sodium (Na). Parmi les silicates les plus connus, on peut citer : le quartz, les feldspaths, le mica, la tourmaline, le béryl, le zircon …
Sulfate : Composé neutre (sel) comprenant le radical SO4. Exemple : le gypse, à la base de la fabrication du plâtre, est un sulfate de calcium (hydraté) CaSO4 2H2O.
Sulfure : Composé chimique du soufre (symbole S) avec différents matériaux et notamment des métaux : sulfures de … sodium (Na2S), de fer (FeS2 dit Pyrite), de plomb (PbS dit Galène), de zinc (ZnS dit sphalérite) … ce qui est favorisé par l’attirance de l’ion S-2 et des métaux (qui perdent facilement des électrons. Mais, il existe aussi, par exemple, du sulfure d’hydrogène (H2S) et de carbone (CS2).